Антибиотикорезистентность
Антимикробная химиотерапия стала одной из причин, приведших к увеличению продолжительности жизни в ХХ веке. Однако с течением времени бактерии научились приспосабливаться к действию АБП и в настоящее время антибиотикорезистентность является глобальной проблемой. Так, по данным зарубежных ученых до 70% бактерий, вызывающих внутрибольничные инфекции, резистентны как минимум к одному АБП. Настораживают данные о росте антибиотикорезистентности среди возбудителей внебольничных инфекций, особенно это характерно для стафилококков и пневмококков [2, 3, 12].
Антибиотикорезистентность бывает 2 видов:
- природная – характеризуется отсутствием у бактерий мишени действия АБП или недоступности мишени вследствие первично низкой проницаемости или ферментативной инактивации. При наличии у бактерий природной устойчивости, АБП клинически неэффективны. Природная резистентность является постоянным видовым признаком микроорганизмов и легко прогнозируется;
- приобретенная – развивается у части представителей конкретного вида микроорганизмов. Приобретенная резистентность может возникать как в результате мутаций в конституциональных генах (в этом случае передача гена резистентности не происходит),так и посредством приобретения экзогенных детерминант резистентности от других микроорганизмов путем горизонтального (латерального) переноса генов (в этом случае возможна дальнейшая передача гена). Необходимо отметить, что в случае приобретенной резистентности клиническая эффективность АБП снижется не всегда.
Основные механизмы резистентности бактерий к АБП
Основные механизмы резистентности бактерий к АБП, применяемым в амбулаторной практике, представлены ниже.
Модификация мишени действия: наиболее значимым этот механизм является для стафилококков и пневмококков. Мишенями действия бета-лактамов ПСБ бактерий, участвующие в синтезе клеточной стенки бактерий. В результате модификации у некоторых ПСБ уменьшается сродство к бета-лактамам, что проявляется в повышении МПК этих препаратов и снижении клинической эффективности. Гены модифицированных ПСБ локализованы на хромосомах. Устойчивость стафилококков (S. aureus и КНС) обусловлена появлением у бактерий дополнительного ПСБ (ПСБ2а). Устойчивость пневмококков обусловлена появлением в генах, кодирующих ПСБ, чужеродной ДНК. Среди грам(-) бактерий устойчивость, связанная с модификацией ПСБ встречается редко.
Модификация мишени действия также является ведущим механизмом резистентности к фторхинолонам. У резистентных бактерий выявляется модификация двух бактериальных ферментов ДНК-гиразы и топоизомеразы IV. Модификация мишеней действия обусловлена мутациями в генах, кодирующих ДНК-гиразу (гены gyrА и gyrB) и топоизомеразу IV (гены parC и parE). Гены обоих ферментов локализованы на бактериальной хромосоме [2, 3, 12].
Ферментная инактивация антибиотика: является наиболее распространенным механизмом резистентности микроорганизмов к бета-лактамам, при котором происходит ферментативная инактивация АБП в результате гидролиза одной из связей бета-лактамного кольца бета-лактамазами.Продукция бета-лактамаз встречаются у большинства клинически значимых микроорганизмов, за исключением бактерий рода Streptococcus. Помимо бета-лактамаз описаны ферменты, инактивирующие макролиды и линкозамиды (продуцируются грам(+) и грам(-)бактериями), однако клиническое значение ферментов, инактивирующих макролидные антибиотики, невелико. В настоящее время в клинической практике используются 3 ингибитора бета-лактамаз – клавулановая кислота, сульбактам и тазобактам, которые способны предотвращать гидролиз бета-лактамов. Необходимо отметить, что не все бета-лактамазы чувствительны к действию ингибиторов, например, хромосомные бета-лактамазы классов С и А грам(-) бактерий не чувствительны к ингибиторам [2, 3, 12].
Активное выведение АБП из микробной клетки (эффлюкс): данный механизм наиболее распространен среди грам(+) бактерий (S. pneumoniae, S. pyogenes) и обеспечивает активное выведение макролидов и линкозамидов. Основное клиническое значение имеет система выведения, кодируемая mef-геном. Специфический белок-транспортер выводит 14- и 15-членные макролиды и обеспечивает невысокий уровень резистентности, при этом, линкозамиды и 16-членые макролиды сохраняют свою активность, однако в клинической практике это не имеет преимуществ. У стафилококков и энтерококков активное выведение макролидов, но не линкозамидов, осуществляют транспортные системы другого типа, кодируемые генами msr. Существуют также транспортные системы, осуществляющие избирательное выведение некоторых препаратов, например линкомицина или олеандомицина. Эффлюкс является наиболее распространенным механизмом защиты грам(+) и грам(-) бактерий от тетрациклинов. Детерминанты резистентности обычно локализованы на плазмидах, что обеспечивает их быстрое внутри- и межвидовое распространение. В последнее время также появляются данные о широком распространении среди грам(+) и грам(-) бактерий резистентности, связанной с активным выведением хинолонов. У штаммов с высоким уровнем устойчивости к фторхинолонам этот механизм часто сочетается с модификацией мишени действия [2, 3, 12].
Нарушение проницаемости внешних структур микробной клетки: этот механизм резистентности характерен для грам(-) бактерий и обеспечивает их защиту от действия бета-лактамных АБП. Поступление бета-лактамов внутрь клетки грам(-) бактерий происходит через белковые структуры – пориновые каналы. При возникновении мутаций возможна утрата пориновых каналов, что затрудняет поступление АБП внутрь клетки и сопровождается снижением чувствительности бактерии к препарату [2, 3, 12].
Почему медицинские работники должны знать о проблеме антибиотикорезистентности?
- Потому что антибиотикорезистентность может приводить к неэффективности терапии: инфекция, вызванная устойчивым к АБП штаммом, труднее поддается терапии, увеличивается длительность заболевания и повышается риск летального исхода; при неэффективности терапии пациент в течение более длительного времени остается источником инфекции и способствует тем самым ее распространению.
- Медицинские работники могут способствовать росту антибиотикорезистентности, назначая АБП в ситуациях, когда в них нет необходимости: при простуде, гриппе, боли в горле и кашле (при отсутствии признаков бактериальной инфекции).
- Во всем мире наблюдается рост антибиотикорезистентности: многие значимые возбудители бактериальных инфекций приобретают устойчивость к широко применяемым и эффективным в настоящее время АБП.
- Некоторые «проблемные» бактерии (например, MRSA) в настоящее время встречаются не только в стационарах, но и все чаще вызывают инфекции во внебольничных условиях, что создает проблемы в их своевременной диагностике и адекватном лечении.
- Потому что антибиотикорезистентность – это дорого: в дополнение к расходам, связанным с удлинением сроков лечения и более высоким риском летального исхода, инфекции, вызванные резистентными бактериями, требуют назначения более дорогостоящих и потенциально более токсичных антибиотиков резерва.
- Рациональное использование АБП является ключом к контролю над проблемой роста антибиотикорезистентности.
- Некачественные генерические препараты часто не соответствую оригинальному препарату по содержанию активного вещества, показателям фармакокинетики и, следовательно, микробиологической эффективности. Это также может способствовать росту резистентности.
Состояние резистентности к АБП возбудителей внебольничных инфекций дыхательных путей
В последние годы в большинстве стран мира отмечается значительный рост резистентности к АБП среди возбудителей как нозокомиальных, так и внебольничных инфекций. В настоящее время антибиотикорезистентность, наряду с терроризмом, рассматривается в качестве угрозы национальной безопасности.
В настоящее время принято выделять 3 уровня резистентности к АБП – глобальный, региональный и локальный. Важно учитывать глобальные тенденции в распространении антибиотикорезистентных бактерий, например, во многих странах отмечается рост устойчивости к АБП у стафилококков, пневмококков, гонококков и др. Тем не менее, выбор АБП должен основываться, прежде всего, на данных об уровнях региональной и локальной антибиотикорезистентности.
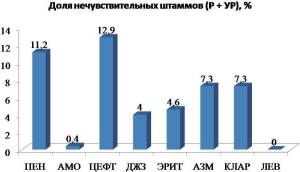
Streptococcus pneumoniae: по данным проспективного многоцентрового микробиологического исследования ПеГАС III (2006-2009 гг.) в РФ отмечается высокий уровень устойчивости пневмококков к ко-тримоксазолу (39% нечувствительных штаммов) и тетрациклину (24,6%). Также выявлен относительно высокий уровень устойчивости к пенициллину (11,2%нечувствительных штаммов) и пероральным цефалоспоринам IIIпоколения – цефтибутену (12,9%) и цефиксиму (6,8%). Наиболее активными против пневмококков среди пероральных АБП были амоксициллин и амоксициллин/клавуланат (0,4% нечувствительных штаммов), джозамицин (4%), эритромицин (4,6%), мидекамицин (6%), азитромицин и кларитромицин (7,3%) (рисунок 3). Также необходимо отметить, что не было выявлено штаммов, устойчивых к респираторным фторхинолонам - левофлоксацину, моксифлоксацину и гемифлоксацину [6].
Рисунок 3. Резистентность S. pneumoniae к АБП в РФ по данным исследования ПеГАС III.
Примечание. ПЕН – пенициллин, АМО – амоксициллин, ЦЕФТ – цефтибутен, ДЖЗ – джозамицин, ЭРИТ – эритромицин, АЗМ – азитромицин, КЛАР – кларитромицин, ЛЕВ – левофлоксацин.
Streptococcus pyogenes: по данным исследования ПеГАС III все штаммы S. pyogenesсохраняли чувствительность к пенициллину, что вполне согласуется с данными, полученными в других странах.
Следует отметить в целом низкий уровень резистентности БГСА к макролидам [7]. Так, наиболее активными макролидами были эритромицин (0,8% нечувствительных штаммов),спирамицин (1,4%), джозамицин (1,7%), кларитромицин (3,3%), мидекамицин (4,1%) и азитромицин (10%) (рисунок 4).
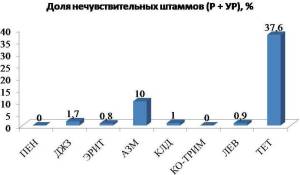 Рисунок 4. Резистентность S. pyogenes к АБП в РФ по данным исследования ПеГАС III.
Рисунок 4. Резистентность S. pyogenes к АБП в РФ по данным исследования ПеГАС III.
Примечание. ПЕН – пенициллин, ДЖЗ – джозамицин, ЭРИТ – эритромицин, АЗМ – азитромицин, КЛД – клиндамицин, КО-ТРИМ – ко-тримоксазол, ЛЕВ – левофлоксацин, ТЕТ – тетрациклин.
Наряду с этим, выявлен низкий уровень устойчивости к клиндамицину (1%), что может свидетельствовать о том, что резистентность БГСА к макролидам и линкозамидам обусловлена, в основном, активным выведением АБП из микробной клетки (эффлюкс). Таким образом, принимая во внимание низкий уровень устойчивости БГСА к макролидам и линкозамидам в РФ, эти препараты можно рекомендовать для эмпирической терапии в амбулаторной практике в качестве альтернативы бета-лактамам.
Была выявлена высокая активностьinvitro ко-тримоксазола (100% чувствительных штаммов), однако данный АБП обладает худшим, чем бета-лактамы и макролиды, профилем безопасности, а так же создает относительно невысокие концентрации в тканях миндалин при применении в стандартных дозах [7].
Левофлоксацин и моксифлоксацин сохраняли высокую активность против БГСА (0,9% и 0,2% нечувствительных штаммов, соответственно), что позволяет использовать эти препараты для терапии стрептококковых инфекций у взрослых пациентов.
Необходимо отметить, что к тетрациклинам наблюдался наиболее высокий уровень резистентности (37,6% нечувствительных штаммов), что согласуется с общемировыми тенденциями. С учетом такого высокого уровня резистентности, тетрациклины не должны назначаться при лечении инфекций, вызванных БГСА [7].
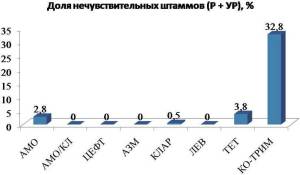
Haemophilusinfluenzae: данные исследования ПеГАС III свидетельствуют о высокой активности бета-лактамов в отношении H.influenzae [8]. Так, частота выделения нечувствительных к амоксициллину штаммов составляла 2,8%, при этом амоксициллин/клавуланат и цефтибутен были активны в отношении 100% выделенных штаммов (рисунок 5).
Высокой антигемофильной активностью обладали и макролиды – азитромицин был активен в отношении 100% штаммов, к кларитромицину были чувствительны 99,5% штаммов H.influenzae.
Следует отметить, что левофлоксацин и моксифлоксацин были активны против 100% выделенных штаммов.
Рисунок 5. Резистентность H. influenzae к АБП в РФ по данным исследования ПеГАС III.
Примечание. АМО – амоксициллин, АМО/КЛ – амоксициллин/клавуланат, ЦЕФТ – цефтибутен, АЗМ – азитромицин, КЛАР – кларитромицин, ЛЕВ – левофлоксацин, ТЕТ – тетрациклин, КО – ТРИМ – ко-тримоксазол.
Тетрациклин был активен в отношении 96,2% штаммов H. influenzae. Однако тетрациклин не может быть рекомендован для эмпирической терапии ИДП ввиду высокого уровня резистентности к нему пневмококка – одного из ведущих респираторных патогенов.
Следует отметить, что наиболее низкой активностью invitro из всех протестированных АБП в отношении исследованных штаммов H. influenzaeобладал ко-тримоксазол, к которому были нечувствительны 32,8% микроорганизмов [8].